Cancer : les immenses espoirs soulevés par les anticorps thérapeutiques
Publié par Echosciences Sud Provence-Alpes-Côte d'Azur, le 4 novembre 2021 1.4k
Eve Playoust, Aix-Marseille Université (AMU)

Cet article est publié dans le cadre de la Fête de la science, qui a lieu du 1er au 11 octobre 2021 en métropole et du 5 au 15 novembre 2021 en outre-mer et à l’international, et dont The Conversation France est partenaire. Cette nouvelle édition a pour thème : « Eureka ! L’émotion de la découverte ». Retrouvez tous les événements de votre région sur le site Fetedelascience.fr.
Les anticorps sont au cœur de nombreuses problématiques de recherche comme nous le montrent si bien la pandémie actuelle de Covid-19 et les stratégies de vaccination qui en découlent. Cela n’est pas sans raison : ils jouent un rôle central dans la défense de notre organisme contre les envahisseurs.
Ces molécules – aussi appelés « immunoglobulines » sont naturellement produites par des cellules appelées lymphocytes B à la suite de la reconnaissance d’une molécule étrangère ou néfaste à notre organisme pour lutter contre une agression. On se sert donc de ce mécanisme pour la vaccination. Pour préparer notre système immunitaire à une rencontre avec un pathogène connu (par exemple, le virus SARS-CoV-2) on l’y expose de manière sécure afin qu’il produise des anticorps contre ce virus et que notre organisme puisse se défendre efficacement lors d’une réelle infection.
Cependant notre système immunitaire joue d’autres rôles essentiels, parfois méconnus : il occupe par exemple une place centrale dans la défense de notre organisme contre les tumeurs. De ce fait, les anticorps sont au cœur de stratégies thérapeutiques anticancéreuses, sur lesquelles scientifiques comme médecins fondent aujourd’hui de grands espoirs.
Une brève histoire des anticorps
La première mise en œuvre des fonctions des anticorps date d’une époque où l’on ne soupçonnait pas encore leur existence, ce qui n’a pas empêché de les mettre à profit. Au XVIe siècle, en Chine, on pratiquait en effet la variolisation : des germes de la variole (maladie extrêmement contagieuse et mortelle à cette époque) étaient inoculés à des personnes saines, car il avait été observé que les malades ayant survécu à une première infection étaient ensuite en quelque sorte protégés contre cette maladie. Ces pratiques ont plus tard été exploitées également en Europe, où des découvertes majeures se sont produites.
En 1796, le médecin et scientifique anglais Edward Jenner réussit à immuniser ses patients contre la variole, à l’aide de vésicules de vaccine (maladie bovine similaire à la variole, mais bénigne pour l’être humain), selon un procédé bien plus sûr que le procédé de variolisation.

C’est ensuite au tour de Louis Pasteur de contribuer considérablement à la lutte contre des maladies mortelles. Après avoir travaillé avec ardeur pendant de nombreuses années à l’immunisation de poules contre le choléra, il sera le premier à mettre au point un vaccin vivant atténué, c’est-à-dire un vaccin dérivé d’un réel agent pathogène, mais rendu moins virulent par différents procédés, afin que l’on puisse l’injecter.
Ces expériences sur le choléra des poules permettront à Louis Pasteur de mettre au point et d’administrer en 1885 le premier vaccin contre la rage à un jeune garçon mordu par un chien enragé. Malgré ces premiers succès considérables, au début du XXe siècle les anticorps demeurent des substances mystérieuses, et les mécanismes d’action mis en œuvre restent inconnus.
Il faut attendre 1890 pour que les anticorps soient identifiés par le médecin prussien Emil Adolf von Behring et son collaborateur, le médecin et bactériologiste japonais Shibasaburo Kitasato. Ils observent dans le sang d’animaux exposés à la diphtérie ou au tétanos, mais pourtant protégés contre ces maladies, des substances qu’ils appellent dans un premier temps des « anti-toxines », nommées ensuite anticorps. Ils sont les premiers à déduire que ce sont ces composés qui garantissent une protection immunitaire aux animaux infectés. Ces recherches vaudront à Von Berhing l’attribution du premier prix Nobel de Médecine ou Physiologie, décerné en 1901.
Ces découvertes historiques ont constitué les prémices d’une aventure majeure. En effet, des avancées scientifiques et thérapeutiques primordiales ont vu le jour suite à leur découverte il y a 130 ans. Comme nous allons le voir, ces accomplissements traduisent la richesse de la science fondamentale. Guidée en amont par la curiosité qui anime un chercheur, elle permet en aval des applications thérapeutiques bouleversantes pour les vies humaines.
Des soldats multitâches
Au cours du XXe siècle, les travaux visant à élucider la structure et les fonctions des anticorps se sont multipliés. On sait aujourd’hui qu’ils disposent par exemple d’une fonction neutralisante : une fois produits, ils peuvent bloquer directement certains pathogènes pour éviter leur interaction avec nos cellules, les empêchant par exemple d’y pénétrer pour en prendre le contrôle, dans le cas des virus.
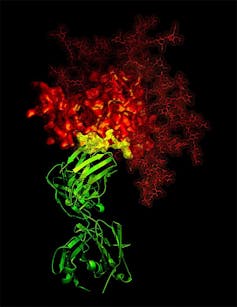
Cette fonction « neutralisante » n’est pas la seule fonction des anticorps. Ils peuvent également activer les fonctions de défense d’autres cellules immunitaires en se fixant sur elles : en se fixant sur des cellules appelées macrophages, (les « éboueurs de l’organisme », dont le rôle est entre autres d’engloutir les débris cellulaires), ils déclenchent par exemple la phagocytose (absorption puis digestion) des pathogènes précédemment reconnus.
Les anticorps, malgré leur petite taille, sont essentiels puisqu’ils contribuent à maintenir l’intégrité de notre organisme face aux diverses agressions auxquelles il est soumis. C’est d’eux dont dépend la mise en place d’une réponse immunitaire robuste, à grande ampleur et de longue durée contre les envahisseurs.
Aider le système immunitaire à combattre le cancer
Notre système immunitaire fonctionne en établissant une distinction entre les éléments qui constituent le « soi », autrement dit, notre corps, et le « non soi », ce qui lui est étranger. C’est ainsi que certaines cellules peuvent donner l’alerte quand un microorganisme étranger pénètre dans notre organisme.
Mais au sein du « soi », le système immunitaire peut aussi discerner quelles sont les cellules anormales, qui pourraient, à la suite d’altérations diverses (mutations), se mettre à proliférer de manière anarchique et non contrôlée, conduisant à l’apparition de cancers. Au cours des années 1950, la compréhension du rôle crucial joué par le système immunitaire dans le processus de contrôle de la croissance tumorale a bouleversé la conception des traitements anticancéreux.
Comme l’ont énoncé les scientifiques Frank Macfarlane Burnet et Lewis Thomas, le développement d’une tumeur dépend d’un équilibre : celui qui existe entre la surveillance des cellules cancéreuses par le système immunitaire, et les capacités de ces dernières à lui échapper. Ce concept mène à un réel changement de paradigme : au lieu de tenter uniquement d’exercer une action toxique sur les cellules tumorales pour les détruire, l’objectif est désormais d’aider en parallèle le système immunitaire dans sa lutte antitumorale. Il s’agit du principe des immunothérapies, dans lesquelles le système immunitaire est au centre de la stratégie thérapeutique.
Une question persiste néanmoins : si notre système immunitaire exerce une veille permanente, pourquoi développons-nous des cancers ?
Quand les cellules cancéreuses piratent le système immunitaire
Il faut savoir que toute réaction immunitaire, une fois déclenchée par exemple dans un contexte infectieux, doit pouvoir être contrôlée, freinée, pour éviter qu’elle ne s’emballe, ce qui pourrait avoir des conséquences délétères sur notre organisme. Les cellules immunitaires disposent donc de « freins immunitaires », qui servent à inactiver leurs fonctions une fois leur action menée à bien.
Or, au sein de ce que l’on appelle le microenvironnement tumoral, l’endroit où les cellules tumorales prolifèrent, ces dernières sont capables d’usurper ces freins. En les activant, elles limitent l’action du système immunitaire qui va à leur encontre, et continuent à proliférer.
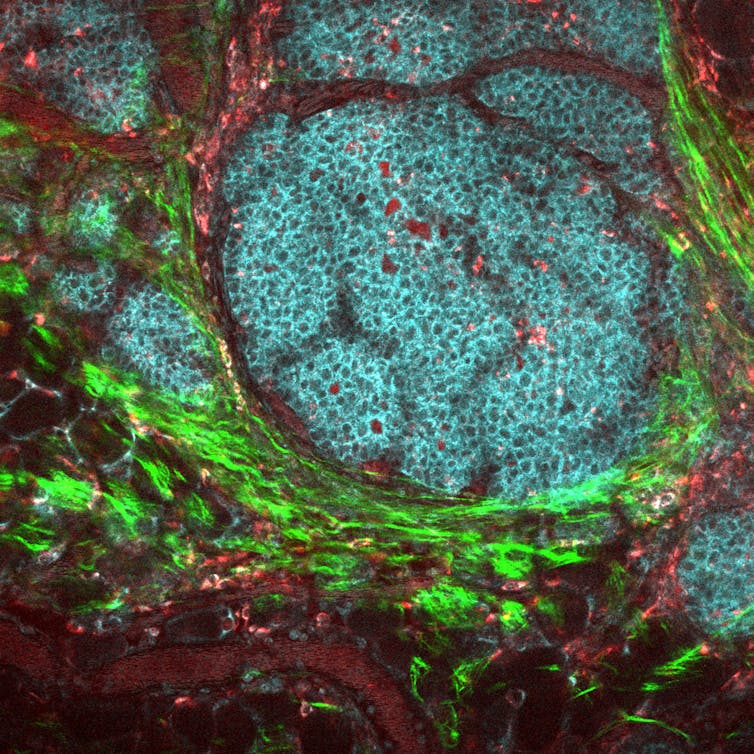
Dans les années 2000, l’immunologiste Robert D. Schreiber a théorisé trois phases aboutissant au développement d’un cancer. Durant la première phase, dite « élimination », l’activité des cellules immunitaires à l’encontre des cellules tumorales se produit efficacement : l’armée des défenses de l’organisme décime toute cellule anormale. Il arrive cependant que cette armée perde du terrain ; on entre alors dans la seconde phase dite « d’équilibre », entre l’action des cellules tumorales et le combat mené par les cellules immunitaires. Lorsque le système immunitaire est acculé et ne parvient plus à contrôler les cellules cancéreuses, l’envahissement est inévitable. On entre alors dans la troisième phase, « l’échappement », où la tumeur prend le contrôle.
Ce concept implique qu’il existe une fenêtre étroite au travers de laquelle les immunothérapies peuvent jouer le rôle d’alliées efficaces, apportant leur soutien aux cellules immunitaires dans leur lutte antitumorale.
Une révolution thérapeutique en devenir
Les immunothérapies visent à rétablir et potentialiser l’action antitumorale du système immunitaire. Parmi ces thérapies, les anticorps thérapeutiques sont développés pour être capables de se lier précisément à certains récepteurs des cellules.
Ces thérapies dites « ciblées » sont rendues possibles par la très grande spécificité des anticorps pour une cible donnée. Par exemple, en bloquant des récepteurs inhibiteurs de cellules immunitaires telles que les lymphocytes T (récepteurs PD-1 considérés comme des « freins immunitaires ») ils empêchent l’action néfaste et usurpatrice des cellules tumorales.
Ces thérapies ont eu un retentissement énorme dans la prise en charge des patients atteints de cancers. Le prix Nobel de Physiologie ou médecine en 2018, attribué aux immunologistes japonais et américain Tasaku Honjo et James Allison, a récompensé les travaux de recherches cruciaux accomplis au sein de la discipline médicale et scientifique émergente que représente l’Immuno-oncologie.
Les immunothérapies sont considérées comme une réelle révolution thérapeutique dans la prise en charge des patients atteints de cancer. Malheureusement, seule une fraction des patients répond correctement à ces traitements et de nombreux échecs thérapeutiques demeurent. Les mécanismes de résistance qui sous-tendent ces derniers ne sont pas encore bien compris.
Pour améliorer la situation, les chercheurs en Immuno-oncologie mènent actuellement un nombre considérable de recherches afin de découvrir de nouvelles cibles thérapeutiques à bloquer, ou de mieux caractériser les rôles de certaines cellules immunitaires qu’il pourrait être utile de potentialiser. L’espoir suscité par ces nouveaux traitements est immense, à la hauteur de l’enjeu : selon l’Organisation mondiale de la Santé, le cancer est actuellement la deuxième cause de décès dans le monde.
Découvrez également le podcast d'Eve Playoust :

Eve Playoust, Doctorante en Immunologie, Aix-Marseille Université (AMU)
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.





